本网讯 日前,开云官方注册_开云(中国)食品药品制造工程学院韩铭海副教授课题组在Journalof Biotechnology上发表了题为《一种基于Cre/loxP系统敲除毕赤酵母基因的方法》(“A modified method of gene disruption inKomagataella phaffiiwith Cre/loxP system”)的研究论文。

论文截图
毕赤酵母(Komagataella phaffii)是当今商业化生产重组蛋白类产品最常用的宿主之一。这种蛋白表达宿主具有诸多优点:细胞培养密度高、高效而可控的启动子、蛋白翻译后修饰、异源蛋白高效分泌表达、胞外蛋白易于分离和纯化以及公认的安全性等,是当今最受欢迎的蛋白表达平台之一。然而,诸多具有良好商业化应用价值的蛋白仍不能得到高水平的表达,这迫切需要进一步优化改进毕赤酵母蛋白分泌机能。
在2009年,毕赤酵母全基因组测序已完成并公布。在后基因组学研究中,基因操纵是工程改造毕赤酵母最常用的策略,其中基因敲除又是经常使用的技术之一。常规的基因敲除方法需要使用抗生素抗性标记或营养缺陷型标记,而可选择标记是很有限的,这使得删除同一生物体中的多个基因相当困难,阻碍了基础和应用研究的步伐。
而Cre/loxP系统介导的重组提供了筛选标记重复使用的可能性。CRE重组酶催化两个loxP位点之间的重组,不需要任何宿主辅因子或辅助蛋白质。如果位于线性DNA分子上的两个loxP(lox71和lox66)处于同一方向,CRE可以删除它们之间的DNA序列,只留下一个重组的新的loxP(lox72)序列,而新引入的lox72位点是不参与Cre/loxP介导的重组,从而实现永久切除lox71和lox66之间的DNA片段。
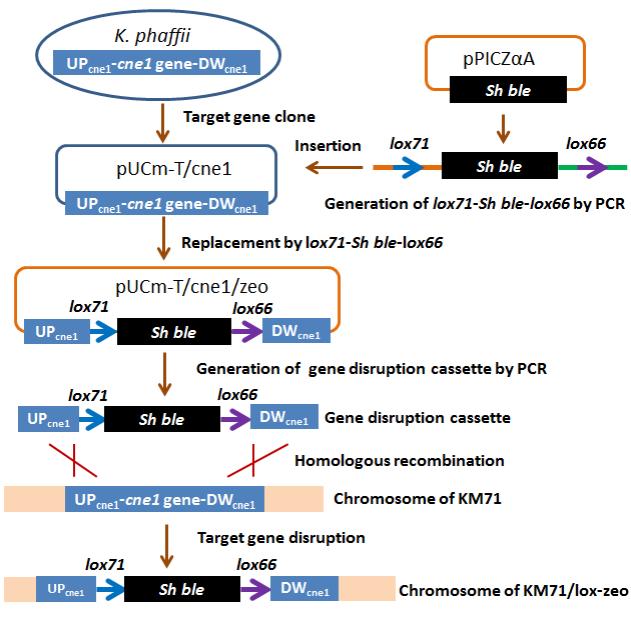
基因表达盒的构建及基因敲除技术路线
在本论文的研究中,课题组设计了一个结构简单的基因敲除盒,它只包含Sh ble基因(ZeocinTM抗性基因)和两侧的loxP位点和同源臂(loxP之间只有大约1400bp),而且通过常用的方法就可以构建这个基因敲除盒,不涉及复杂的操作,比如其他类似文献报道的融合PCR技术。而且在该方法中,可实现lox71-Sh ble-lox66序列的模块化,这为敲除多个基因构建多个基因敲除盒的操作提供了便利。
为了引导lox71和lox66之间发生重组,本文构建了含有CRE基因的辅助质粒。该辅助质粒的构建较为简单:在含有CRE基因的通用表达质粒pPICZαA的基础上,引入来源于另外一种通用质粒pAO815的his4基因即可。这个辅助质粒在本文描述的基因敲除技术中是通用的。
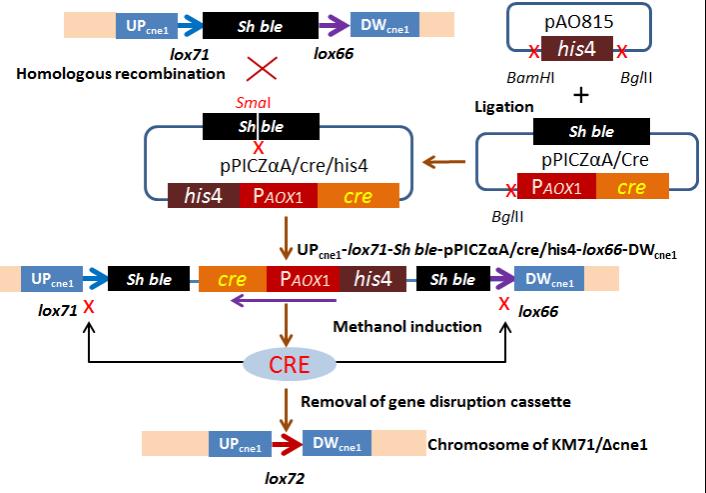
CRE介导重组切除loxP之间DNA序列技术路线
本文描述的基因敲除路线涉及两轮转化。第一轮是基因敲除盒转化宿主,插入到目的基因中(基因取代)。这一轮的转化效率与同源臂的长度相关,一般同源臂控制在1000bp就可以得到相对不错的效率。本文在敲除毕赤酵母的HIS4基因尝试中,同源臂的长度约750bp,就获得了27%的基因敲除效率,这完全能够满足常规实验的要求。第二轮是将辅助质粒转化到基因敲除的宿主中,以恢复ZeocinTM抗性基因的筛选标记。此轮转化(基因插入)效率接近100%。最后,在甲醇诱导的强启动子PAOX1引导下,CRE得到高效表达,并成功地介导lox71和lox66发生重组,其效率也接近100%。